IDMP определяет элементы данных и структуры для уникальной идентификации и обмена информацией о лекарственных средствах.
Скачайте здесь бесплатно PDF-файл «Что такое IDMP»
ISO Краткий обзор стандартов IDMP
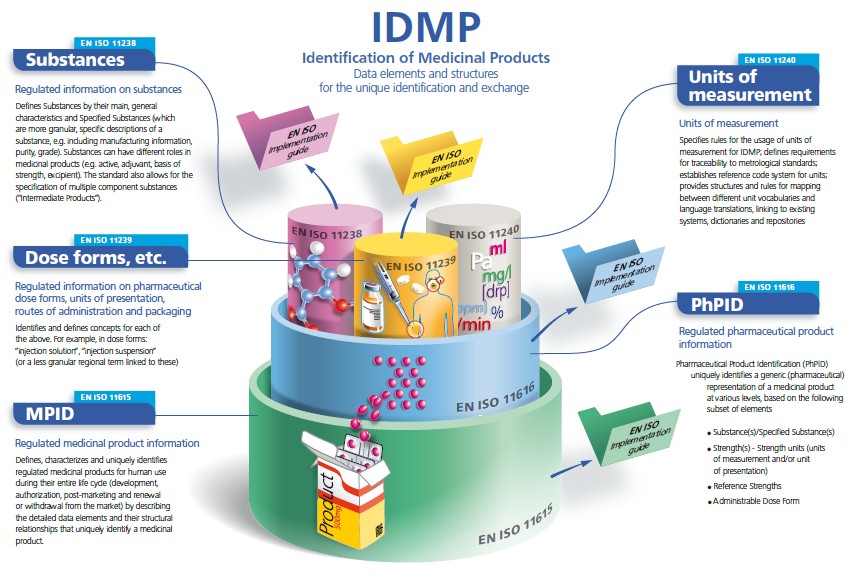
Стандарты ISO IDMP
Набор международных стандартов ИСО был разработан ИСО в ответ на мировой спрос на согласованные на международном уровне спецификации для идентификации и описания лекарственных средств.
Статья 40 нового меры фармаконадзора законодательство обязало EMA использовать стандарт ISO IDMP не позднее июля 2016 года.
IDMP обеспечивает основу для уникальной идентификации лекарственных средств, что облегчает деятельность органов регулирования лекарственных средств во всем мире в рамках юрисдикции для различных видов регулирующей деятельности (разработка, регистрация и управление жизненным циклом лекарственных средств, фармаконадзор и управление рисками). Они также могут быть применены к исследовательским лекарственным средствам.
Спецификации обмена сообщениями включены как неотъемлемая часть стандартов IDMP. Они описывают и защищают целостность взаимодействий для предоставления регулируемой информации о лекарственном средстве в контексте идентификации уникального продукта; они включают подтверждение получения, включая подтверждение переданной информации. Уровень здоровья семь ( HL7 ) Обмен сообщениями является нормативным в рамках стандартов IDMP.
Стандарты IDMP дополняются Руководствами по внедрению, которые в настоящее время находятся в стадии разработки (2015 г.), а также Техническими спецификациями (TS) 16791 (предоставляет руководство по идентификации лекарственных средств с использованием международных стандартов цепочки поставок, обеспечения прослеживаемости, безопасной цепи поставок и др.). требования рынка) и Технические требования (TR) 14872 (Требования к внедрению Стандартов идентификации лекарственных средств для обмена регулируемой информацией о лекарственных средствах), последние находятся в стадии разработки.
Последствия для владельцев маркетинговых разрешений (MAH)
Чтобы предоставить данные, все филиалы компании должны использовать общий язык: от фармаконадзора до поставки продукции, чтобы соответствовать контролируемому словарному запасу.
Будет сложно интегрировать структурированную информацию о веществах и контролируемые словари для лекарственных форм, единиц представления, способов введения и упаковки.
Кроме того, терминология должна быть согласована со всей компанией.
Вы найдете более подробную информацию Вот
Связанные записи
Похожие
Нужен ли сторонний аудит безопасности?По мере появления сообщений об угрозах безопасности и нарушениях данных клиенты хотят получить дополнительную гарантию того, что организации можно доверять их конфиденциальную информацию. Поскольку предприятия стремятся